Berilyum (Be), (1957’ye kadar) glusinyum olarak adlandırılan bir kimyasal elementtir. Berilyum, uzay roketleri ve uydu parçalarını yapmak için kullanılan hafif ve güçlü bir metaldir. 2A grubunda bulunan bir toprak alkali bir metaldir. Berilyum, toz halinde oldukça toksiktir, fakat büyük parçalar halinde nispeten zararsızdır. Berilyum oksit yalıtkan olarak kullanılmaktadır, çünkü elektrik ve ısıyı çok zayıf iletir. Berilyum oksitten yapılan malzemeler seramikler kadar pürüzsüz olabilmektedirler.
Berilyumun Bulunuşu ve Üretimi
Berilyum, oda sıcaklığında oldukça kırılgan olan çelik-gri bir metaldir. Kimyasal özellikleri alüminyuma benzemektedir. Doğada serbest durumda pek bulunmaz. Antik Mısır döneminde beril (Be3Al2(SiO3)6) ve zümrüt aynı mineral olarak biliniyordu. İki mineralin de benzer olduğundan şüphelenilmiş olsa da, bunun kimyasal doğrulaması 18. yüzyılın sonlarına doğru oldu. Zümrüt artık yeşil bir beril çeşididir. Berilyum, Fransız kimyager Nicolas-Louis Vauquelin tarafından beril ve zümrütlerde oksit olarak keşfedildi (1798). Bağımsız olarak Alman kimyager Friedrich Wöhler ve Fransız kimyager Antoine A.B tarafından metal olarak izole edildi (1828).
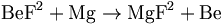
Berilyum Dünya’nın kabuğuna yaygın halde bulunur ve Dünya’nın magmatik kayaçlarında % 0.0002’ye kadar olduğu tahmin edilmektedir. Amerika Birleşik Devletleri ve Çin berilyumun en büyük üreticileridir; diğer büyük üretici ülkeler arasında Mozambik, Madagaskar ve Portekiz bulunmaktadır.
Berilyum Bileşikleri
Berilyum bütün bileşiklerinde +2 oksidasyon durumuna sahiptir. Genellikle görünümü renksiz ve tatlı bir tada sahiptirler. Bu nedenle elementin eski ismine glusinyum denilmiştir. Küçük parçacıklara bölünmüş metal çözeltisi, toz hali ve duman biçimindeki bileşikleri toksiktir; solunduğunda akciğerlere ciddi boyutlarda hasar verebilir. Berilyum ile çalışan insanlarda akciğer hacminin azalması ve zehirli gaz fosgenin (COCl2) neden olduğu etkilere benzer etkiler bırakır.
Oksijen ile bileşiği berilyum oksittir. (berillia, BeO) Berilyum, yüksek elektriksel dirence ve yüksek ısı yalıtkanlığı ile dielektrik dayanımının olağan dışı bir kombinasyonu sayesinde karakterize edilen yüksek sıcaklıklı bir refrakter maddedir (erime noktası 2,530° C ). Bu özelliği yüzünden roket motorlarında, nükleer enerji reaktörlerinde geniş bir kullanım alanına sahiptir.
Berilyum İzotopları
Berilyumun sadece bir tane kararlı izotopu vardır. Bu izotop Be-9 olarak adlandırılır. Kozmojenik berilyum (Be-10) ise oksijen ve azotun kozmik ışın yayılımı ile oluşur. Berilyum, çözelti içinde pH seviyesi yaklaşık 5.5’ten daha düşük seviyelerdedir. (çoğu yağmur suyunun pH’ı 5’ten daha azdır) Dünya yüzeyine yağmur suyu ile taşınır. Be-10 izotopunun yarılanma ömrü 1,5 milyon yıldır. B-10’a (bor) bozulmadan önce uzun bir süre toprak yüzeyinde birikir. Be-10 yardımıyla, toprak erozyonu, regolitten toprak oluşumu, lateritik toprakların gelişimi, ayrıca güneş aktivitesi ve buzul çekirdeklerinin yaşını incelemek için kullanılmıştır.
Berilyumun Kullanım Alanları
- Berilyum, berilyum bakır tel üretiminde bir alaşım olarak kullanılır. (Yüksek miktarda ısı soğurma yeteneğine sahiptir.) Berilyum-bakır alaşımları, elektriksel ve ısıl iletkenlikleri, yüksek mukavemet ve sertlikleri, manyetik olmayan özellikleri, iyi korozyon ve yorulma direnci ile birlikte çok çeşitli uygulamalarda kullanılır. Bu uygulamalar şunları içerir: nokta kaynak elektrotları, yaylar, kıvılcım çıkarmayan aletler ve elektrik kontakları.
- Sertlik, hafiflik ve geniş bir sıcaklık aralığına olan dayanımı yüzünden; saf berilyum ve alüminyum-berilyum metal matris kompozitleri, savunma ve havacılık endüstrisinde, yüksek hızlı uçaklarda, füzelerde hafif yapı malzemeleri olarak kullanılır. Uzay araçları ve haberleşme uydularında da kullanılmaktadır.
- Berilyum ayrıca jiroskoplar, çeşitli bilgisayar donanımları, saat yayları ve hafiflik-sağlamlık ve boyutsal kararlılık gerektiren aletlerin yapımında da kullanılır.
- Berilyum mikroskobik entegre devreler üretimi için kullanılır.
- İnce berilyum levha tabakaları, görünür ışığı filtrelemek ve sadece X ışınlarının tespit edilmesinde kullanılır.
- Düşük bir termal nötron soğurma alanı olduğundan, nükleer enerji endüstrisinde nötron reflektörü ve düzenleyici olarak kullanır.
- Berilyum bileşikleri bir zamanlar flüoresan aydınlatma lambalarında da kullanıldı, ancak bu kullanım, tüpleri üreten işçilerdeki berylliosis (bir tür akciğer hastalığı) görülmesi nedeniyle kesildi.
Berilyumun Özellikleri
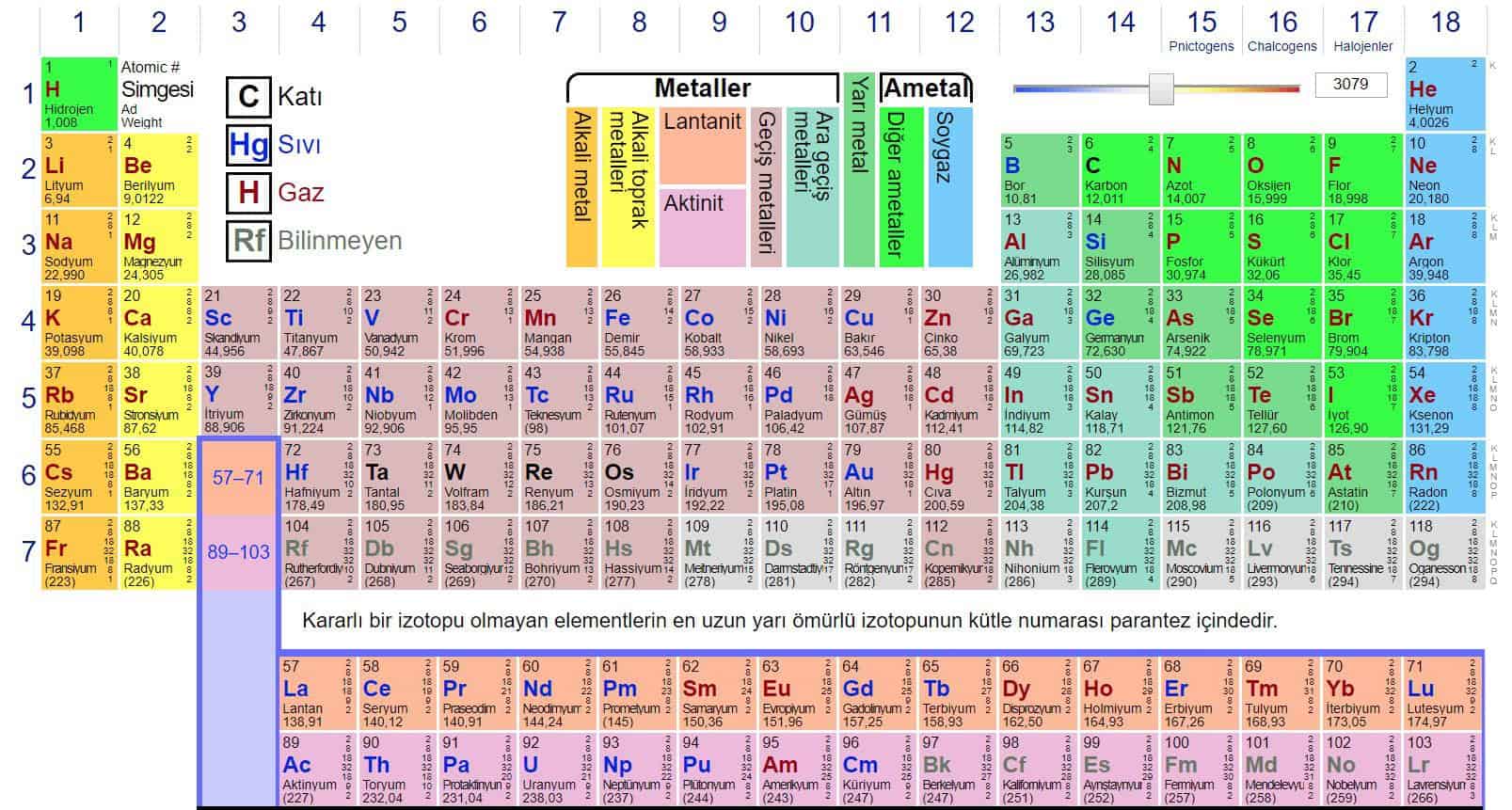
| Genel Özellikleri | |
|---|---|
| Sembol | Be |
| Atom numarası | 4 |
| Grup | 2A, Alkali Toprak Metal |
| Yoğunluk, Sertlik | 1848 kg/m3, 5.5 |
| Görünüm | beyaz-gri metalik |
| Atom Özellikleri | |
| Atom ağırlığı | 9.01218 amu |
| Atom yarıçapı | 112 pm |
| Kovalent yarıçapı | 90 pm |
| Van der Waals yarıçapı | Bilinmiyor |
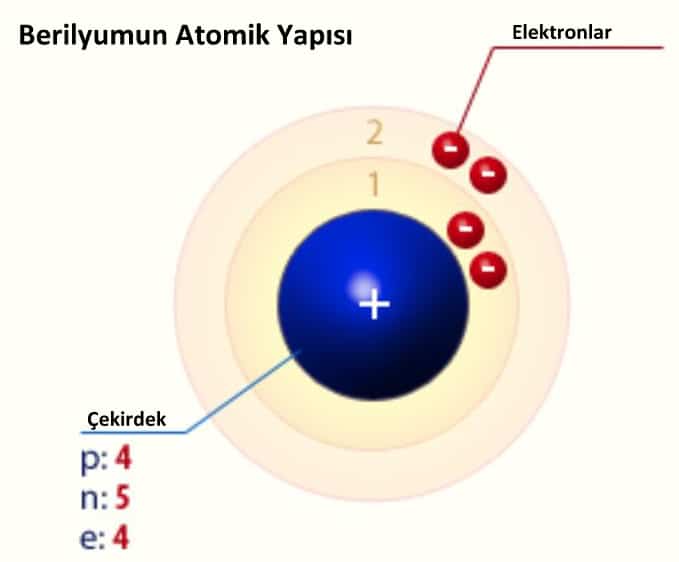
| Elektron konfigürasyonu | [He]2s2 |
| e–s başına enerji miktarı | 2, 2 |
| Oksidasyon derecesi | 2 (amfoterik) |
| Kristal yapısı | Altıgen |
| Fiziksel Özellikleri | |
| Maddenin hali | Katı (diyamanyetik) |
| Erime noktası | 1551.15 K |
| Kaynama noktası | 3243.15 K |
| Molar hacim | 4.85 ×10-6 m3/mol |
| Buharlaşma ısısı | 292.40 kJ/mol |
| Füzyon ısısı | 12.20 kJ/mol |
| Buhar basıncı | 4180 Pa |
| Ses hızı | 13000 m/s |
| Diğer Özellikleri | |
| Elektronegativite | 1.57 (Pauling ölçeği) |
| Özgül ısı kapasitesi | 1825 J/kg*K |
| Elektriksel iletkenlik | 31.3 106/m ohm |
| Termal iletkenlik | 201 W/m*K |
| 1. iyonlaşma potansiyeli | 899.5 kJ/mol |
| 2. iyonlaşma potansiyeli | 1757.1 kJ/mol |
| 3. iyonlaşma potansiyeli | 14848.7 kJ/mol |
pm: Picometre
Berilyum absorpsiyon spektrumu
Berilyum emisyon spektrumu
Berilyumun Atomik Yapısı
Berilyumun Dağılımı
- Evren: % 1×10-7 oranında berilyumdan oluşmaktadır.
- Güneş: % 1×10-8 oranında berilyumdan oluşur
- Okyanus: % 6×10-11 oranında berilyumdan oluşmaktadır.
- İnsan vücudu: % 4×10-8 oranında berilyumdan oluşur